2020年7月1日,新版GCP的正式实施,国内临床研究领域最具纲领意义的管理规范尘埃落定。为配合新版GCP的施行,2020年6月19日,CCHRPP与RDPAC联合发布了《临床试验安全性报告管理工作指引(试行版)》(以下简称"指引"),旨在提供新政之下临床试验安全性信息管理的落地执行方法和行为标准。《指引》发布后,引起行业的广泛关注和热论。本文将从多个维度来解读《指引》的主要思路和意图,并针对近期遇到的行业共性问题给出相应解决方案。

《指引》制定的主要思路
新版GCP正式实施后,申办方、研究者、研究机构等相关方,从基于SAE报告的试验药物安全管理调整为基于SUSAR报告的整体管理,报告总量下降的同时,重要的安全性信息将得到进一步凸显。对此,研究机构、伦理的安全性信息接收、审阅和审查等流程均需要一定程度的调整和适配。然而,各研究机构的管理模式、信息化程度不尽相同,制定一个既符合各方业务及合规诉求,又能为不同的研究机构提供可借鉴的行动路径至关重要。对此,《指引》工作组参考ICH-E6、新版GCP、ICH E2B等国际规范、国内法规及行业经验编撰而成。
倡导建立信息化沟通平台
在临床试验安全性信息管理方面,新版GCP对申办者和研究者的职责划分进行了大刀阔斧的改革。申办者作为临床试验的发起人、主体责任人和药物警戒职责的第一人,必须时刻关注试验药物的风险。收到任何来源的安全性相关信息后,申办者应当立即分析评估,基于事实作出科学独立的判断,包括严重性、与试验药物的相关性以及是否为预期事件等;与研究者开展风险沟通,向所有参与试验的研究中心告知可疑且非预期严重不良反应(以下简称SUSAR)等药品未知的风险。
和以往不同的是,申办者负责将SUSAR分发至所有参加临床试验的研究者、临床试验机构及伦理委员会,如何有效分发SUSAR,确保接收方成功收到、签收SUSAR,跟踪每一份SUSAR的签收情况,成为每一位申办者在开展临床试验工作时面临的挑战。
对于研究者而言,"无需再递交SAE至药监部门"看似减少了工作量,实际上却是把重心回归到更严谨的安全性数据分析和受试者保护等工作中。研究者需接收来自申办者的SUSAR报告,及时了解、分析药品潜在的未知风险,以更好地保护受试者的健康与安全,并上报临床研究机构及伦理委员会,以对风险进行及时干预。
如何在繁忙的临床试验工作中,有效便捷地收到报告,让SUSAR报告及时流转至临床试验机构及伦理委员会,与申办者保持风险沟通,是研究者开展临床试验中面对的挑战。
面对职责改变后的种种挑战,申办者和研究者之间急需建立一个信息化平台,利用信息化的优势建立完善、合规的风险处理链条,以满足临床试验安全性信息的快速接收、判别、沟通与跟踪,降低沟通成本。
对此,《指引》第七章提出,应保证信息化系统具备以下功能:安全性信息的上传和接收、安全性信息审阅、风险预警、伦理审查、痕迹记录。如果信息化系统能与申办者的药物警戒系统实现对接,进行安全性信息的交互,则将进一步提升安全性信息的管理效率。
提倡使用符合E2B要求的标准化表格
对于困扰行业多年的SAE报告表的格式问题,《指引》的相关表述为"2020版GCP要求申办者将SUSAR快速报告给所有参加临床试验的研究者及临床试验机构、伦理委员会、以及药品监管部门和卫生健康主管部门。为减轻负担,提高效率,建议使用满足E2B要求的标准化表格(尽量涵盖全面的字段),有条件的可使用信息化系统来收集和上报SAE至申办者,同步到药物警戒系统。需注意采用受试者匿名化信息。"
符合ICH E2B要求的标准化表格
ICH E2B(R3)指南文件从元素层面规定了每一个用于描述药品个例安全性报告的数据元素,在信息层面规范了数据元素间的关系与以及这些数据元素如何组成有用的信息,从而传递药品的安全性信息。
因此,设计标准化表格时,需要考虑收集哪些信息,哪些元素是必要的,真实场景下收到的数据会是什么样子,以及这些信息最终将如何呈现,这些信息间存在怎样的对应关系(是一对一,还是一对多)。
当符合E2B标准的SAE报告表被统一使用后,申办者就可以从源头上把控药物警戒数据质量,并从中汇总出有效信息,最终为试验药品的安全管理提供指引和依据。
解决方案
基于新版GCP和《指引》的原则与精神,为了解决申办者、研究者、临床试验机构和伦理委员会在临床试验安全性信息管理中的痛点,助力申办者、研究者、临床试验机构和伦理委员会实现安全性数据的全流程管理,太美医疗科技于2020年6月23日重磅发布了最新研发的临床研究安全性信息管理系统——"SAE管家"。
SAE管家可实现SUSAR跨项目一键分发,从而解决申办者的SUSAR分发难题;
对回执记录进行即时统计,申办者的SUSAR回执获取难题也迎刃而解;
嵌入SAE标准化表格,CRC/研究者在线填写后,可一键传输给申办者,事半功倍。
临床试验机构及伦理委员会端的SAE管家(通过eSite机构管理系统进入)具备数据统计分析、安全预警等功能,赋能安全性信息统筹管理,提升受试者安全保障能力;标准数据的建立,操作留痕等功能对于GCP检查,相关临床试验检查等工作也将发挥很大的作用。
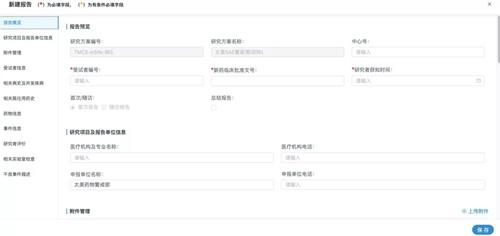
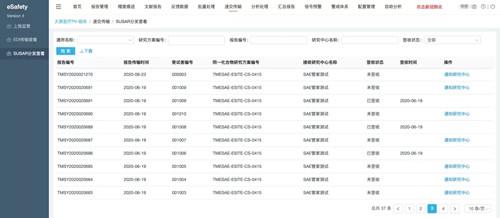
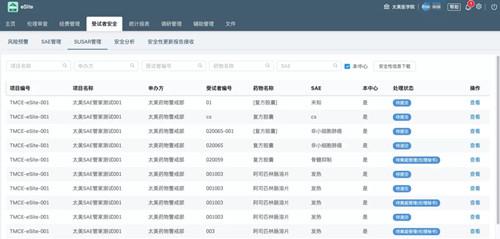
此外,SAE管家还可通过加密通道传输、多级权限控制,保证数据安全、稳定;前道录入至后道分析、逻辑核查及必填项提醒,造就高质量临床安全性数据;完全符合《指引》第七章中对于安全性信息的上传、接收、审阅、电子传输合规性、统计分析与风险预警及稽查轨迹的相应要求,可全系统化实现申办者与研究者的数据协作、沟通,形成临床药物警戒管理闭环。
常见实施问题
Q1.研究者填报SAE报告为何建议使用新的表格?
相较SAE报告,SUSAR报告对信息颗粒度的要求更加细致,由于新版GCP规定的流程中,SUSAR是必备的核心工作流程文档,因此在个例信息的填报之初即使用满足E2B R3要求的标准表格,有助于全面、精确的评估患者安全信息,快速识别SUSAR并减少不必要的质疑沟通。
Q2.怎样协调SAE报告相关性判断的不同意见?
药物-事件的相关性判断难以精准评估,往往带有一定的当事者主观因素。因此当申办者与研究者在针对单个SAE报告相关性的判断产生不同意见时,需通过质疑沟通等方式进行进一步确认,如需更改原有的评估意见,则相应质疑内容应一并作为原始资料与报告进行关联。同时,在极端情况下,无如法在规定的时限内(常见7/15天)达成一致,则其中任一方判断不能排除与试验药物相关的,也应快速报告,时限原则优先。在后续达成一致时,则可通过追加随访报告的方式向相关各方通报更新后的内容。
Q3.相关性判断的依据尚不充分时应如何处理?
《指引》建议采用保守原则,无法确认药物-事件组合为无关时,则一般视为有关。在2019年4月11日发布的《药物临床试验期间安全性数据快速报告常见问答(1.0版)》中,也有类似表述:"A9."无法评价"、"未知"表述不规范,但均无法除外相关性,需要按照SUSAR快速报告"。
Q4.如何判断SUSAR报告已成功分发研究者、伦理/机构?
SUSAR已经分发给了所有已立项开展研究项目的研究中心,且通过电子系统、邮件或其他方式完成发送后,获得了签收回执(研究者回执、伦理以及机构回执)。每份SUSAR报告的递交证明应由申办方统一维护管理,以备查验。采用邮件方式发送时,发送成功并不代表对方已经成功接收,因此仍需获得签收回执。
Q5.双盲试验中,如何保证分发SUSAR时不存在"主观揭盲"的情况?
申办方因SUSAR评估进行揭盲操作后,通常结果为:可预期的SAE、确认SUSAR、与安慰剂相关的非预期严重不良事件、与对照药相关的非预期严重不良事件。该报告进行递交时,确认的SUSAR只单独向CDE进行递交。而所有的上述情况中,确认SUSAR、与安慰剂相关的非预期严重不良事件、与对照药相关的非预期严重不良事件都应分别向卫健委、研究者、伦理、机构完成递交。在递交时上述三种情况导出的递交报表,均应执行复盲操作。同时,与安慰剂相关的非预期严重不良事件、与对照药相关的非预期严重不良事件不再向CDE进行递交。
太美医疗科技秉承"让好药触手可及"的使命,正在构筑未来医药行业运行的基础设施,从而令新药更快上市,保障患者用药安全,让好药易于获得,同时,降低患者的医疗负担。
作为生命科学产业数字化运营平台,太美医疗科技以云计算、人工智能等先进技术为依托,自主研发完整的专业软件产品线,并打造基于技术的专业服务体系,业务覆盖医药研发、药物警戒、医学事务、市场准入和市场营销等领域。公司创新性打造以协作为核心理念的TrialOS平台,链接医院、制药企业、服务商、监管机构、患者、支付方等行业参与者,实现数据的顺畅流转,流程的紧密合作,并统一行业标准,从而带来产业的价值升级与共赢。
(免责声明:本网站内容主要来自原创、合作伙伴供稿和第三方自媒体作者投稿,凡在本网站出现的信息,均仅供参考。本网站将尽力确保所提供信息的准确性及可靠性,但不保证有关资料的准确性及可靠性,读者在使用前请进一步核实,并对任何自主决定的行为负责。本网站对有关资料所引致的错误、不确或遗漏,概不负任何法律责任。
任何单位或个人认为本网站中的网页或链接内容可能涉嫌侵犯其知识产权或存在不实内容时,应及时向本网站提出书面权利通知或不实情况说明,并提供身份证明、权属证明及详细侵权或不实情况证明。本网站在收到上述法律文件后,将会依法尽快联系相关文章源头核实,沟通删除相关内容或断开相关链接。 )